Les entropies
On revoit l'entropie...
Bon en gros, tout vient de Clausius, un Allemand, qui tout en comprenant et propageant les théories de Carnot, invente le concept d'"entropie" en 1865.
En gros, on a la formule bien connue
dW = P dV qui exprime que la pression relie un changement de volume dans le piston à l'énergie produite.
La question de l'énergie est aussi la question de la chaleur. Alors que l'énergie se conserve (premier principe), la chaleur aussi ou du moins il en reste toujours quelque chose, seule la différence de chaleur produisant de l'énergie. On a alors une formule équivalente:
dQ = T d ??? la grandeur qui change ici étant la mystérieuse "entropie" forgé par Clausius à partir du grec "transformation", et qui ne peut varier que dans un sens.
On peut le formuler en disant que la production d'énergie ( de travail) dépend d'une passage de chaleur entre deux sources, dont l'une est chaude et l'autre froide, et que la quantité moindre de chaleur rendue à la source froide est relative à sa température, les deux quantités Q_chaud/T_chaud et Q_froid/T_froid étant égales.
En fait, ce qu'on appelle la thermodynamique tire sa complexité de l'expression de son second principe, exprimé avant toute statistique par Carnot puis Clausius, et qui exprime que la variation d'entropie INTERNE à un système est toujours positive. Un système isolé, sans variation EXTERNE, et du fait de son évolution INTERNE,évolue donc vers un état d'entropie maximale.
Tout est dû bien sûr à la température et à la chaleur, la physique statistique, élaborée en fin de siècle donnant les clés du mystère, et encore, il fallut attendre Boltzmann pour que l'entropie soit identifiée à des configurations en nombres si grands que l'on ne peut qu'y être, l'entropie étant alors une mesure du désordre résultant de cette accumulation d'états équivalents.
.S = K log O
K est la constante de Boltzmann (1,38 10-23), O étant le nombre de configurations (vitesses, positions, dénombrées de manière spéciale).
L'entropie est nulle au zéro absolu ou tout est gelé, il n'y a qu'une seule configuration possible.
Cette évolution identifiée à un "temps" effectif, matérialisé, est due en fait à une inhomogénéité dans l'espace. La flèche du temps et donc d'abord une flèche de l'espace (héhé), c'est à dire un adoucissement progressif des gradients d'espace qui décrivent l'homogénéité de l'ensemble de particules en évolution.
C'est le paradoxe fascinant source non pas de chaleur, mais de considérations variées de bien des gens.
On rappellera la loi d'Avogadro (Ampère aussi) qui dit qu'à température, pression donné, un volume de gaz contient toujours le même nombre de molécules, quel que soit le type de gaz "parfait" considéré, et donc quelque soit la masse de gaz considéré. Le nombre Na, le nombre d'Avogadro, fut longtemps le nombre d'atomes contenus dans 12 grammes de carbone 12 : Na = 6,0 10^23, constante devenue conventionnelle et donc fixe depuis 2019.
Bien sur, le nb d'atomes dans 12 g de carbone 12, continue d'être mesuré de plus en plus précisément, mais cela ne change rien à l'affaire.
La constante des gaz parfaits qui relie tout ça avec le nombre de "moles" considéré (une mole, c'est Na particules) utilise comme multiplicateur la constante de Boltzmann:
k = 1,38 10-23.
R = k * Na, et bien sur,
PV = NRT (N nb de moles).
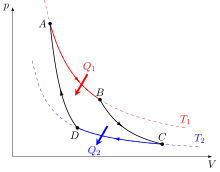
On évoquera alors ici la question du moteur à vapeur, décrit en détails par Carnot. Le gaz refroidi pour fournir de l'énergie a changé de volume (le piston poussé travaille) MAIS AUSSI de pression, car évidemment pendant que ça pousse on est resté à la même température (on passe de A en B). Se pose alors la question du cycle du moteur: il faut bien revenir à l'état initial d'une manière ou d'une autre pour faire un deuxième tour de roue... Et bien pour cela, on doit comprimer, pour que le piston revienne en position. Le problème est qu'on ne peut pas comprimer en restant à la même température, cela reviendrait à consommer toute l'énergie qu'on vient de produire !!!
On doit donc être malin et commencer par refroidir le gaz (de B vers C), afin de passer de C en D, ce qui consommera une énergie inférieure à celle produite ! Il suffit alors de chauffer (monter en température, en brulant quelquechose) pour revenir à l'état initial... Le rendement du moteur sera alors positif, égal à : (Q1 - Q2 ) / Q1 soit: 1 - Q1/Q2
Il faut noter que le moteur à explosion fonctionne suivant un cycle différent, dit de Beau de Rochas, à quatre temps, également, mais qui inclut des mouvements de soupape pour faire entrer le mélange d'air et d'essence...
Parmi les généralités oiseuses qu'on peut faire au sujet de l'entropie, j'aime bien celle qui me vient à l'esprit et qui considère que la sexualité (c'est l'histoire du piston qui m'y fait penser) comme irruption massive d'externalité dans des systèmes qui pourraient se prétendre isolés, est bien une source de néguentropie. Prends ça dans ta gueule, théorie du genre !